一方、製薬企業や研究機関はCDISC標準への準拠性を確実に検証した上で試験データを提出するために、英文で数百ページにおよぶCDISCの実装ガイドを参照しながら確認する必要がありますが、多大な負荷を要するとともに、目視で確認することは大変困難であり現実的ではありません。
そこで当社は、米国の規制当局 Food and Drug Administration (以下、FDA)や大手製薬企業において高い導入実績をもつ試験データの品質検証・管理ツール「Pinnacle 21 Enterprise」を販売するPinnacle 21 LLC(本社:米国ペンシルベニア州フィラデルフィア郊外、CEO:Max Kanevsky)と販売契約を締結し、日本で唯一本サービスの提供を開始します。
富士通グループでは、CDISC標準に準拠した臨床試験データを容易に作成・管理するシステムとして「tsClinical Metadata」を提供しており、「Pinnacle 21 Enterprise」と合わせて、製薬企業の医薬品申請業務を強力に支援します。
【「Pinnacle 21 Enterprise」の主な特長】
1.国際標準への準拠性を複数の指標で測定
医薬品開発データの国際標準であるCDISCの実装ガイドでは、表記項目から、用語、データの格納方法やそれらデータの解析モデル表記にわたり詳細に規定されています。「Pinnacle 21 Enterprise」では、試験データがCDISCに準拠しているかどうかを複数の視点できめ細かく検証し、ダッシュボード画面で視覚的にわかりやすく表示します。これにより、申請前に課題を発見しデータの精度を高めることができるため、申請の手戻りを防止し審査の遅延を防ぐことができます。
2.エラー項目を効果的に管理・共有し、課題解決を強力に支援
臨床・非臨床試験データがCDISC標準に準拠していなかった項目は、対応の優先度とともに一覧でエラー表示されます。また、項目ごとに担当者を割り付けることが可能です。関連項目は分類表示され、コメント機能で注意事項やアドバイスを受けることもできるため、担当者は効率よく課題に対処することができます。
3.臨床・非臨床試験データの属性定義情報(Define-XML)を容易に作成可能
臨床・非臨床試験データを提出する際には、それらのデータ属性を定義した情報「Define-XML」も提出が求められます。「Pinnacle 21 Enterprise」を使えば、臨床・非臨床試験データをアップロードするだけで、容易にこの「Define-XML」を作成できます。また、「Define-XML」の自動作成中に、属性情報が不足している箇所がリアルタイムで表示されるため、担当者はエラー表示された項目に順次属性情報を追加していくことができます。
【販売価格(税別)】
620万円より
【販売目標】
今後3年間で50社
【商標について】
記載されている製品名などの固有名詞は、各社の商標または登録商標です。
【関連URL】
「tsClinical Metadata」について
(リンク »)
以 上
≪お客様お問い合わせ先≫
第一産業ソリューション本部 第二事業部 第一ソリューション部
電話: 03-6712-3739(直通)
受付時間: 9時~17時30分(土曜日・日曜日・祝日・年末年始を除く)
≪報道関係お問い合わせ先≫
ビジネスマネジメント本部 グループマネジメント推進統括部(広報担当)
電話: 03-6712-3701(直通)
このプレスリリースの付帯情報
用語解説
(注1)CDISC:Clinical Data Interchanges Standards Consortiumの略で、臨床研究に関わるデー
タ・メタデータの取得、交換、申請、アーカイブに関する一連のデータ標準を定めるNPO団体
(注2)わずか数分:CDISCで公開されているUpdated Pilot Submission Packageのデータで検証した場合
お問い合わせにつきましては発表元企業までお願いいたします。
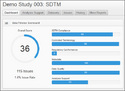 検証結果のダッシュボード画面
検証結果のダッシュボード画面 
